L'extension d'indication, le jackpot des laboratoires pharmaceutiques
Lancer un nouveau médicament, c'est long, cher et risqué. Du coup, les laboratoires révèlent de nouvelles indications pour des médicaments existants. Une procédure parfois justifiée mais aussi source de dérives.
Si le Mediator, à l'origine préconisé dans la cadre d'un régime chez les diabétiques avec surcharge pondérale, a été prescrit comme anorexigène en dehors de toute autorisation, certains médicaments bénéficient, eux, d'un champ d'application étendu en toute légalité. On appelle cela les extensions d'indication et ces dernières se multiplient depuis 10 ans.
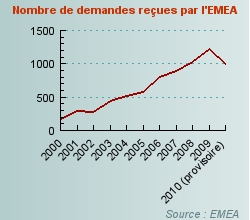
En 2010, au moins 29 dossiers ont ainsi été déposés à l'Agence européenne du médicament (EMEA) pour des extensions d'indication et 966 dossiers pour des changements de forme ou de mode d'administration (variations de type II nécessitant une nouvelle autorisation de mise sur le marché).
Cette tendance n'est pas due au hasard. Les recherches pour aboutir à un nouveau médicament se chiffrent en milliards d'euros pour un laboratoire et le résultat demeure toujours incertain. On se souvient ainsi du flop de l'Acomplia, la pilule anti-obésité de Sanofi-Aventis, pour laquelle le laboratoire avait pourtant mené des études sur plus de 6 000 patients à travers le monde.
Mais au-delà de limiter la prise de risques, les extensions d'indications s'avèrent aussi un filon particulièrement lucratif pour les laboratoires.
Une autorisation de mise sur le marché initiale coûte 250 000 euros, une extension moins de 76 000 euros
D'abord, parce que c'est moins cher. Alors qu'un laboratoire doit débourser 254 100 euros de frais de dossier pour une autorisation de mise sur le marché (AMM) initiale, une extension d'indication coûte "seulement" entre 57 200 et 76 300 euros.
De plus, "le dossier est moins épais et prend moins de temps à être examiné" pour délivrer l'autorisation, souligne Bruno Toussaint, le rédacteur en chef de la revue indépendante Prescrire. Les effets indésirables, par exemple, sont déjà connus et il n'y a donc pas besoin de faire des études supplémentaires.
Doper son cours de bourse
Le bénéfice ne s'arrête pas là. "Saucissonner les indications, c'est bon pour la bourse, résume Bruno Toussaint. A chaque nouvelle annonce d'autorisation de mise sur le marché, le cours de l'action est dopé", ajoute-t-il.
"A chaque nouvelle annonce d'autorisation de mise sur le marché, le cours de l'action est dopé."
En juin 2009, l'anticancéreux Avastin de Roche a par exemple reçu le feu vert de l'EMEA pour une nouvelle indication lui permettant d'être associé à une chimiothérapie en traitement du cancer du sein. La même journée, le titre Roche était en hausse de 2,1% à Zurich.
Prolonger la durée d'un brevet
Autre avantage : une nouvelle indication permet d'obtenir jusqu'à trois ans d'exclusivité supplémentaire avant la perte d'un brevet. Le 25 janvier 2011, Sanofi Aventis et Bristol Myers Squibb ont ainsi obtenu une prolongation de brevet de six mois au Etats-Unis pour le Plavix (un antiagrégant plaquettaire), le deuxième médicament le plus vendu au monde. Une prolongation accordée grâce à une simple extension d'indication à la pédiatrie, mais qui devrait permettre aux deux laboratoires de consolider 2,8 milliards de dollars de ventes supplémentaires selon le site spécialisé Pharmactua.
"Multiplier les indications pour des cibles très étroites permet d'obtenir un maximum d'aides".
Dans certains cas, l'astuce sert même à percevoir un maximum d'aides. Les médicaments orphelins, qui touchent moins de 5 individus sur 10 000, bénéficient de divers soutiens, y compris financiers, pour stimuler la recherche.
"Multiplier les indications pour des cibles très étroites revient ainsi à obtenir des aides à chaque dépôt de dossier", dénonce Bruno Toussaint. Exemple : le Glivec, un médicament de Novartis, est indiqué dans 9 maladies orphelines différentes.
La technique du "pied dans la porte"
Parfois, il n'est même pas la peine d'attendre l'AMM pour tirer les bénéfices du stratagème. "Il suffit que le laboratoire suggère au médecin que le médicament bénéficiera bientôt d'une nouvelle AMM dans un domaine donné pour que le médecin se laisse tenter et prescrive le médicament", affirme Bruno Toussaint. Le problème, c'est que cela peut poser des difficultés de remboursement.
Et l'avantage pour le patient, dans tout ça ? Là encore, tout dépend des cas. Sur les 31 médicaments bénéficiant d'une extension d'indication en 2009, "seuls trois apportent un certain progrès thérapeutique", note Prescrire. La revue pointe ainsi du doigt le Cymbalta, un psychotrope prescrit dans certains cas d'incontinence, de douleurs et dans la dépression. Ce médicament, commercialisé par Eli Lilly, a récemment bénéficié d'une extension d'indication dans l'anxiété généralisée, "malgré des effets indésirables disproportionnés par rapport à une efficacité incertaine".
En savoir plus
Comme pour la procédure de demande d'autorisation de mise sur le marché (AMM) pour un nouveau médicament, le laboratoire doit déposer un dossier à l'agence française de sécurité sanitaire des produits de santé (AFSSAPS) ou à l'agence européenne du médicament (EMEA).
Comme pour la procédure de demande d'autorisation de mise sur le marché (AMM) pour un nouveau médicament, le laboratoire doit déposer un dossier à l'agence française de sécurité sanitaire des produits de santé (AFSSAPS) ou à l'agence européenne du médicament (EMEA).
Le dossier doit contenir des données et des essais cliniques qui apportent la preuve de l'efficacité et de la sécurité du médicament dans cette indication.
Le médicament est alors évalué par les évaluateurs internes et les experts externes qui rendent un avis sur le rapport entre les bénéfices apportés par le médicament et les risques, dans cette nouvelle indication. Cela peut concerner aussi bien des médicaments récents ou des anciens médicaments.
Et aussi sur le Journal du Net